中国与韩国专利链接制度中的“确认之诉”之比较
目次
一、韩国专利链接中的“权利范围确认之诉”
二、我国“请求确认是否落入专利权保护范围之诉”与韩国“权利范围确认之诉”之比较
三、我国“请求确认是否落入专利权保护范围之诉”存在的问题
我国《专利法》第四次修改确立了药品专利纠纷早期解决机制(也称专利链接制度),并且在程序上引入了“请求确认是否落入专利权保护范围”这一全新的诉由,旨在为专利权人就仿制药企在专利保护期内提交上市申报行为的提起诉讼提供程序法上的依据。综观世界各国的立法及实践,“请求确认是否落入专利权保护范围”之诉与《韩国特许法》第135条所规定的“权利范围确认之诉”非常类似,或者说,我国药品专利纠纷早期解决机制中的“请求确认是否落入专利权保护范围”之诉,在很大程度上借鉴了韩国专利制度中“确认之诉”的机制。但实际上,中韩两国专利链接中的“确认之诉”存在着许多差异,这些差异决定了制度实施效果的不同。厘清这些差异,有助于我们重新审视我国药品专利纠纷早期解决机制的程序规则,并进行完善。
一、韩国专利链接中的“权利范围确认之诉”
1. 韩国专利法中的“权利范围确认之诉”的立法背景及立法目的
韩国的“权利范围确认之诉”借鉴了1921年《日本特许法》中权利范围行政确认制度的相关规定。日本专利法中引入该制度起初是为了解决不同专利权之间保护范围重叠的问题,后来为了使专利权纠纷能够获得专利局的审查,而扩大了其适用范围。鉴于对其法律性质以及效力范围(是具有对世效力还是仅对当事人具有拘束力)争论不休,1959年《日本特许法》修订时废止了该制度,变更为不具有法律效力的行政判定制度沿用至今。[1]
而韩国在其1946年的《特许法》中首次明确规定了“权利范围确认之诉”,由于是由行政机关韩国知识产权局(KIPO)知识产权审判与上诉委员会(IPTAB)进行的准司法程序,该制度一般也称为“权利范围行政确认”制度。
现行有效的《韩国特许法》第135条规定,(1)专利权人及独占被许可人为了确认获得专利的发明的保护范围,可以请求确认专利权的权利范围(即积极的权利范围确认请求);(2)利害关系人为了确认他人获得专利的发明的保护范围,可以请求确认专利权的权利范围(即消极的权利范围确认请求);(3)在提交第(1)项和第(2)项请求时,若有多个权利要求,可以对每个权利要求分别提出请求。这是目前韩国专利制度中“确认之诉”的最直接法律依据。
韩国的多数研究者认为,这一制度是在韩国专利制度尚未得到充分发展,法官专业性不足的背景下引入的,旨在解决难以准确理解和判断发明专利的技术内容问题。而在目前专利制度已经健全的情况下,该制度的有用性还体现在技术专业性强,以及能够作出快速判断。[2]而韩国IPTAB的《韩国审判概览》就这一制度的目的则指出,“有必要向具备专业性和丰富的技术见解的知识产权审判与上诉委员会提出请求,快速作出权威性的判断,以判断结果为依据,尽快解决当事人之间的纠纷,或者避免无意义的纠纷。”[3]
2. 韩国专利法中的“权利范围确认之诉”的程序
韩国司法实行三级三审制。目前,与知识产权相关的案件审判涉及的三级分别为韩国知识产权审判与上诉委员会(IPTAB)、韩国专利法院和大法院(韩国最高法院)。
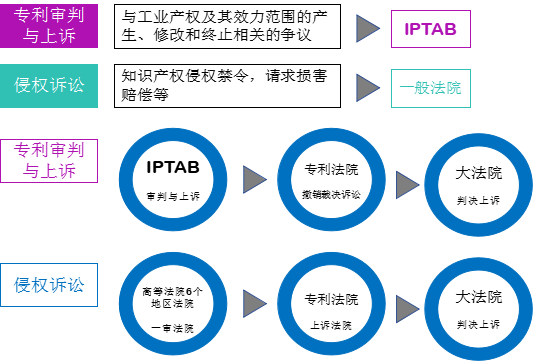
图1:韩国专利案件的管辖[4]
其中,IPTAB是在合并了原审判委员会和上诉委员会的基础上成立的,于1998年3月1日起开始运作。它是韩国知识产权局中的准司法机构,作为知识产权相关案件的第一审级在KIPO中完全独立运作(类似但不完全等同于中国2018年3月机构改革之前的专利复审委员会在国家知识产权局中的位置)。IPTAB审理的专利案件包括单边程序案件(如专利驳回,专利修改),双边程序案件(如专利无效,专利保护期延长无效,权利范围确认,专利修改无效,授予非独占许可等)以及专利异议案件。而依据《韩国特许法》第135条提起的权利范围的确认作为其中一类双边程序案件,由IPTAB负责第一审级的审查。《韩国特许法》对权利范围的行政确认的效力未作特殊规定。根据《韩国审判概览》的解释,权利范围的行政确认类似于民事诉讼中的确认之诉。[5]IPTAB依据专利复审的一般规定就权利范围的行政确认请求作出审查决定,作为准司法机构,其所作出的决定对当事人具有约束力。如图1所示,当事人对审查决定不服的,可以依据《韩国特许法》第186条向韩国专利法院申请司法复审,并可进一步上诉到韩国大法院(即韩国最高法院)进行终审。与专利无效案件一样,专利法院对确认之诉进行的司法复审程序同样是专利权人和涉嫌侵权人之间的争议。IPTAB并不会成为被告。实践中,双方当事人通常会在二审程序中达成调解或和解。
3. 关于“权利范围确认之诉”的争议
权利范围的确认的审查内容是请求确认的技术方案是否落入专利权保护范围是专利侵权诉讼中必须审理的内容,因此,权利范围确认之诉与专利侵权之诉存在一定的重叠和冲突。该制度的存废之争亦不绝于耳。其主要理由包括:权利范围的确认缺乏独立确认的利益[6];解释专利权利要求以界定专利权保护范围是司法机关的职责,权利范围的行政确认则有悖于司法权与行政权的分工;权利范围的确认之诉与侵权之诉并行,将导致双重诉讼,不仅浪费诉讼资源,其结果的相互冲突和矛盾也导致当事人的混乱。[7]基于此,有人提出这个程序并没有太多存在的价值,可以废止该制度,将其并入到其他程序中。
韩国大法院则认为,该程序依旧有存在的价值。一方面,与日本废止该制度时的情况不同,日本废止该制度的其中一个原因是由于该类确认请求的数量持续走低,但韩国此类请求的数量则远高于同时期的专利侵权诉讼;另一方面,权利范围确认之诉可以弥补民事诉讼时间长、成本高等不足,且由于主要请求者集中于中小企业,而权利范围确认之诉不会引发损害赔偿或禁令等法律救济,但由于可以得到对是否落入专利权保护范围的审查结果,有助于协助当事人判断是否提起侵权诉讼,也有助于快速终结当事人之间的潜在侵权纠纷。[8]
鉴于权利范围的行政确具有预防侵权以及快速终结纠纷上的制度功能,其独立地位获得了认可,且该制度在韩国专利制度中发挥着重要作用。特别是在2015年韩国实施专利链接制度后,该制度的作用更为明显。韩国大法院也通过更改侵权案件二审的管辖权,将侵权诉讼的二审由原来的一般高等法院集中到专利法院统一管辖,而专利法院也是确认之诉的二审法院,在一定程度上减少了(但不可能完全消除)两种程序结果不一致的情形。
4. 韩国专利链接制度中的“权利范围确认之诉”
根据《韩国药事法》第50-5条之规定,专利权人在收到仿制药申请人的通知之日起45日内,专利权人或原研药企应向韩国食品药品安全部(MFDS)提交制止仿制药上市的申请。而在提交遏制期的申请前,专利权人应(1)依据《韩国特许法》第126条之规定向法院提起侵权或预防专利侵权之诉,或(2)依据《韩国特许法》第135条之规定向提起积极的权利范围确认(即请求确认仿制药技术方案落入其专利权保护范围)之请求。若仿制药申请人已经向IPTAB提起消极的权利范围确认(即请求确认仿制药技术方案没有落入登载专利的权利保护范围)之请求,则专利权人应予应对,且无需再提起确认请求。根据该条规定,权利范围确认之诉被纳入专利链接的制度范畴,成为“专利挑战”的一种请求类型,而且至少在韩国专利链接制度实施之初发挥着重要作用,这也是韩国一些研究者认为“权利确认范围之诉”有继续存在理由的重要依据。
数据显示,在韩国2015年实施药品专利链接制度的最初几年内,权利范围确认之诉的请求量激增。截止2018年3月,在全面实施专利链接制度3年间,原研药企业和仿制药企业共向IPTAB提交涉及专利链接的请求2928件。2015年,共有无效宣告请求1801件,消极的权利范围确认请求410件;到2017年,无效宣告请求只有22件,而消极的权利范围确认请求共372件。
3年间,IPTAB共审结2248件涉及专利链接的请求。在仿制药企业进行的专利挑战中,无效宣告请求胜诉的有265件(成功率24%),消极的权利范围确认请求胜诉的有465件(成功率74%)。
从前述数据可以看出,就专利挑战请求的类型而言,除了制度实施之初,消极的权利范围确认请求的案件量明显高于无效宣告请求的案件量,其原因在于消极的权利范围确认请求容易被认可,而且该结果仅对特定仿制药企业的特定仿制药有效,其他仿制药企业难以直接利用这一结果。而无效请求如果仿制药企业胜诉,则其他任何相关仿制药企业也都能“搭便车”上市其仿制药。因此,仿制药企业更倾向于选择通过消极的权利范围确认请求来挑战原研药专利。在消极的权利范围确认请求中,作为请求人的仿制药企业需要公开其实施的技术内容或制备方法,但很多时候争论的焦点在于其公开的技术内容或制备方法是否确实与仿制药报批申请的内容一致。而消极的权利范围确认请求成功率高的原因之一在于,请求人公开的技术内容并不触及专利权的内容。
二、我国“请求确认是否落入专利权保护范围之诉”与韩国“权利范围确认之诉”之比较
1. 立法背景及立法目的不同
在韩国专利制度体系中,“权利范围确认之诉”是与专利侵权之诉(基于《韩国特许法》第126条)和专利无效之诉(基于《韩国特许法》第133条)并行的三类相互独立的专利诉讼之一,其直接法律依据是《韩国特许法》第135条。如前所述,该制度规则源于对日本专利法的借鉴,制度引入最初的目的,旨在在法官专业性不足的情况下,解决其难以准确理解和判断发明专利的技术内容问题;而制度延续至今,则旨在实现对复杂技术问题的快速判断,实现预防侵权,快速解决纠纷,以及避免无意义纠纷的目的。与专利侵权之诉和专利无效之诉一样,权利范围确认之诉适用于所有专利法所能涵盖的所有技术领域,当然也包括药品领域。换言之,在韩国专利制度体系中,“权利范围确认之诉”并非为药品领域,尤其是药品专利链接制度所特设,而是在韩国药品专利链接制度实施前,其专利制度体系中已经固有的,即先有“权利范围确认之诉”,后有专利链接制度,后者直接援用了原有制度体系内的程序规则。至于其在韩国药品专利链接制度实施之后,更受当时人的青睐,则与这一制度的作用密切相关。
对于我国的专利制度体系而言,“请求确认是否落入专利权保护范围之诉”是一项全新的诉由,这一诉由,在专利法第四次修改之前,这一诉讼请求作为独立诉讼请求,在司法实践中往往被认为缺乏诉的利益,而不为法院所接受。而我国《专利法》第四次修改引入这一诉由,则是作为新引进的药品专利纠纷早期解决机制(药品专利链接制度)的组成部分,与之同时进入专利法的。因此,探讨这一诉由的出台背景无法脱离我国专利法引入药品专利纠纷早期解决机制的背景,也就是在强化知识产权保护的新形势下,我国医药产业取得了巨大发展,创新能力得到了提升,在需要大力支持、鼓励药品创新,同时又要考虑仿制药企占主导的现状的背景下,我国出台了药品专利纠纷早期解决机制。而专门规定了这一新的诉由,则是为在仿制药上市前提供一种司法或行政的早期解决创新药企与仿制药企之间专利纠纷的解决途径。因此,根据《专利法》第76条的规定,这一诉由的适用范围是“药品上市审评审批过程中,药品上市许可申请人与有关专利权人或者利害关系人,因申请注册的药品相关的专利权产生纠纷的”,而不像韩国的“权利范围确认之诉”可以适用于各个技术领域。简言之,这是为药品领域仿制药上市前纠纷解决而特设的程序,与其他技术领域无涉。
2. 程序不同
如前所述,韩国的“权利范围确认之诉”也称为“权利范围的行政确认”,首先由韩国知识产权局的准司法机构IPTAB进行审查,对审查决定不服,可以进一步上诉到韩国专利法院,乃至韩国大法院。
而我国《专利法》第76条则为“请求确认是否落入专利权保护范围之诉”提供了两种途径:
其一为司法途径,即相关当事人可以向人民法院起诉,请求就申请注册的药品相关技术方案是否落入他人药品专利权保护范围作出判决。根据相关司法解释,此类案件为专属管辖,一审法院为北京知识产权法院,二审法院为最高人民法院知识产权法庭。
其二为行政途径,即药品上市许可申请人与有关专利权人或者利害关系人也可以就申请注册的药品相关的专利权纠纷,向国务院专利行政部门请求行政裁决。根据国家知识产权局的相关规定,此类请求由药品专利纠纷早期解决机制行政裁决委员会负责作出裁决。其裁决结果与仿制药上市审批相关联。至于后续根据《行政诉讼法》相关规定,由法院进行司法复审的结论,则基本不会对仿制药上市审批的结果产生影响。
三、我国“请求确认是否落入专利权保护范围之诉”存在的问题
韩国的权利范围的行政确因其具有预防侵权以及快速终结纠纷上的制度功能,其独立地位获得了认可,因此,尽管对其存废一直存有争议,但在韩国大法院的支持下,该制度一直被保留下来。但关于该制度本身存在的问题和争议的探讨一直存在,包括其与侵权之诉的关系,双重诉讼问题等。
而在我国司法和行政双轨制的程度规则下,我国的“请求确认是否落入专利权保护范围之诉”的问题似乎更为突出。
第一,各类程序的关系、界限、衔接混乱。根据我国之前的司法实践,涉及专利权侵权认定和专利权效力确定的诉由包括三种,即,侵犯专利权之诉、专利无效之诉以及请求确认不侵权之诉。这三类诉讼有明确的诉的利益、起诉条件以及诉讼后果,三类诉讼之间的界限是明确的。而新引入的确认之诉与侵犯专利权、专利权无效和请求确认不侵权之间是什么关系,与这三类诉讼之间的界限是什么,如何与其他诉讼程序相衔接,一直没有明确。
第二,当事人诉累更甚。药监部门可以先行根据行政裁决作出是否批准仿制药上市的决定,而后再进行行政裁决的司法复审,这似乎与韩国的相关规定类似。但与韩国的IPTAB作为准司法机构不同,我国法院对于行政裁决的司法复审属于行政诉讼,其结果可能会导致整个制度设计偏离原来的初衷和轨道,而进入一个更为混乱,不具有确定性,纠纷处理更为复杂,当事人诉累更重的境地。
第三,循环诉讼无法避免。按照目前的制度设计,国务院专利行政部门对确认之诉作出的裁决属于行政裁决,其生效仍然需要人民法院进行裁判(尽管其结果并不会影响仿制药的上市审批)。目前我国法院并没有对专利权效力进行认定的权利,在专利无效行政程序中也没有司法变更权,这与包括韩国在内其他国家和地区的实践并不相同,因此,其结果将可能会与目前的专利无效行政诉讼一样,导致循环诉讼,造成资源的浪费和当事人的诉累。此外,由于在行政裁决的后续行政诉讼,国务院专利行政部门从行政程序中的居中裁判者转变为代位被告,极有可能成为一方当事人的强势代理人,并对另一方当事人的利益造成损害。
第四,双重诉讼是可以预见的结果。如前所述,韩国的“权利范围确认之诉”旨在预防侵权和快速解决纠纷,但其所可能导致的双重诉讼问题,一直是这一制度备受诟病之处。而在药品专利链接制度框架下,韩国食品药品安全部(MFDS)在制度正式实施之前耗费了三年,完成了“绿色清单”登载专利的适格性,尤其是专利权利要求与获批药品的“直接相关性”或直接对应关系的实质性审查。尽管也可能存在仿制药挑战时提交的文字资料与实际生产是使用的技术方案不一致,而引发双重诉讼,但MDFS在绿色清单的建立和管理过程中发挥着积极主动的作用,至少在专利挑战提交的问题资料以及与MDFS的资料之间的一致性是可以有保证的。而在我国的制度规则下,就目前的实践而言,仿制药企的技术方案至少会有三种版本:
其一,其向国家药品审评审批机构(即国家药监局)提交仿制药上市申请时提交的技术方案;
其二,其在药品专利链接诉讼或药品专利链接行政裁决案件中提交的、用以主张其未落入相关专利权保护范围的技术方案;
其三,仿制药获批上市后,其实际生产过程中使用的技术方案。
如果这三者之间存在差异,那么,在确认是否落入专利权保护范围纠纷中,应当以哪一种方案作为对比对象?任凭仿制药企提交对自己有利的证据而缺乏核实机制显然是不妥的。此外,专利权利保护范围与上市药品之间的对应关系几乎是每个纠纷的争议焦点。这些都导致我国药品专利纠纷早期解决机制更类似于一种程序规则,至于是否能在仿制药上市前,真正解决原研药与仿制药之间的纠纷,则不是其考虑的问题。可以预见,即使有了这一制度,在仿制药上市之后的侵权纠纷也不会减少。实际上,正如国家知识产权局条法司负责人在接受记者采访时支出:“专利法新增了专利纠纷早期解决机制,以在相关药品上市前,尽早解决潜在的专利纠纷,为相关当事人提供可供选择的纠纷解决途径,可以更好地平衡专利权人、仿制药企和社会公众利益,提高药品可及性,保障公共健康。需要说明的是,即使未在法定期限内通过这一机制解决纠纷,仍可以另行提起专利侵权纠纷”。[9]因此,双重诉讼的结果是可以预见的。
概言之,作为一项为了匹配药品专利纠纷早期解决机制这一全新机制而新引进的诉由,我国的“请求确认是否落入专利权保护范围之诉”似乎借鉴了干过的“权利范围确认之诉”的做法,但一方面,这些元素在韩国制度中之所以能够正常运作是由于这些元素是与韩国的整体制度框架相匹配的,仅仅因素其中几个元素,难免会有失偏颇,乃至挂一漏万;另一方面,这些元素能否适应中国的国情,能否实现制度设计的目的,乃至能否达到韩国制度的效果,都是值得进一步深入研究的。
注释
【1】姜珍英:《日韩专利行政部门确认专利侵权制度比较研究》,载《知识产权》,2020年第2期。
【2】姜珍英:《日韩专利行政部门确认专利侵权制度比较研究》,载《知识产权》,2020年第2期。
-
上一篇:
-
下一篇:
- WIPO:中国的全球百强科技创新集群数量蝉联第一
- 中国《人工智能法》的立法进程观察
- 巴西与韩国签署工业产权合作协议
- 美国和中国在日内瓦会面讨论人工智能风险
- 专利链接中可登记专利之医药用途专利


